[vc_row][vc_column][vc_column_text]Por Juan Garcés Garcés
EVOLUCIÓN DE LA RADIOLOGIA COMO ESPECIALIDAD MÉDICA
El 8 de noviembre de cada año, por acuerdo de la Organización Mundial de la Salud se festeja el día de la Radiología. La Radiología es una especialidad Médica que se inició con el descubrimiento de los Rayos X el 8 de Noviembre de 1895 por Wilheim Conrad Röntgen, en el Laboratorio del Instituto de Física de la Universidad de Würzburg en la Baviera Alemana.
Röntgen descubre una radiación no conocida cuando experimentaba con descargas eléctricas en tubos al vacío, utilizaba en su investigación el tubo de Crookes el que constaba de un filamento incandescente conectado al polo negativo de la corriente de alto voltaje, cátodo, en el otro extremo del tubo un blanco metálico con cierto grado de angulación, conectado al polo positivo de la corriente eléctrica, ánodo. Los electrones que se desprendían del cátodo incandescente, en ese entonces los llamaban rayos catódicos, se dirigían aceleradamente contra el ánodo, al impactarlo se producía un as de rayos desconocidos, que Röntgen los llamó Rayos X.
Röntgen se dedicó a estudiar estos rayos, encontrando que las siguientes propiedades: se dispersan en línea recta, no se reflejan ni refractan, produces fluorescencia en las pantallas de cianato de platino, velan las placas fotográficas, producen ionización del aire al atravesarlo, y pueden atravesar cartón, madera, tejidos blandos, son detenidos por los huesos y los metales; esta última propiedad es la que permitió realizar imágenes de las estructuras óseas. (Radiografías).
Por el descubrimiento de estos rayos Wilheim Conrad Röntgen recibó la Orden de la Corona del Emperador Guillermo II, la Medalla Runford de la Real Sociedad de Londres, la Medalla Barnard de la Universidad de Columbia, y el Premio Nobel de Física en 1901 (primer premio Nobel de física que se entregaba).
Con el Descubrimiento de los Rayos X se origina una nueva especialidad médica que se la llama Radiología, en español; Radiology, en inglés; y Röntgenology, en alemán.
La Radiología es la ciencia del diagnóstico médico basado en imágenes producidas por radiaciones.
Durante largo tiempo la única radiación utilizada en diagnóstico médico fueron los Rayos X. Los primitivos tubos de Crookes se sofisticaron, se les añadió ánodos giratorios para disminuir el calentamiento, puntos focales cada vez más pequeños, para obtener imágenes más nítidas, se añadió a los equipos de Rayos X anti difusores para disminuir la borrosidad producida por la radiación dispersa, se dotó de pantallas reforzadoras en los chasis porta placas, lo que permitía obtener imágenes con menor radiación.
En cuanto a la fluoroscopía, que es la visualización en tiempo real en pantallas de platino cianuro de bario, las estructuras anatómicas del paciente, no había sufrido muchos cambios hasta los años 50, las imágenes muy pobres con poco brillo, requerían que el radiólogo prepare su visión en la oscuridad usando gafas de luz roja, previo la visualización de las imágenes fluoroscópicas. En los años 50 se inventa el intensificador de imagen, que es un dispositivo electrónico que intensifica la imagen de la pantalla fluoroscópica hasta 50 veces, haciendo posible la instalación de una pantalla de televisión que permite ver las imágenes a luz del día e inclusive en otra habitación. Hasta 1910 los únicos órganos que podían ser radiografiados eran las estructuras óseas que eran opacas a los rayos x, y cuerpos extraños metálicos de ingesta o penetración accidental. Desde el año siguiente del descubrimiento de los rayos x se comenzó a investigar cómo opacificar el tubo digestivo, los vasos, los riñones; En 1910 se crea el primer medio de contraste radio-opaco para el tubo digestivo: el sulfato de bario, que es usado hasta la actualidad, en los años anteriores se había ensayado con aire, mercurio, y con bismuto, en 1928 se desarrolla en New York USA, un contraste para el tubo digestivo a base de Torio, se lo llamó Umbrator se lo retiró del mercado en los años 50 debido a que las radiaciones Alfa y Beta del Torio producían neoplasias del hígado, bazo y médula. En 1930 en Berlín se desarrolla un compuesto mono yodado el Uroselectan y dos años más tarde el Uroseltan B compuesto di-yodado que se usaron hasta los años 50 en estudios urográficos. En 1928 en Detroit USA se desarrolla un medio de contraste angiográfico, el Thorotrast, también como el Umbrathor a base de Torio, que se retiró su patente por las mismas causas en los 50.
Actualmente se han perfeccionado los materiales de contraste yodados, se los usa en urogramas, en angiografía digita, en mamografía contrastada, y en procedimientos de Tomografía Computarizada. Los contrastes óptimos son los químicamente estables, no iónicos, con baja osmolaridad y baja viscosidad; son los que producen menos reacciones indeseables y menos Insuficiencia Renal Inducida.
DIGITALIZACIÓN EN RADIOLOGÍA
La digitalización es la sustitución de lo analógico por lo digital, fue un paso muy importante en el avance de la radiología, lo digital es la representación bidimensional de una imagen empleando BITS, que es la unidad mínima de información compuesta por dígitos binarios: 1 y 0 . Esto fue posible en el año 1953 con el invento del transistor que es un pequeño dispositivo semiconductor que cierra o abre un circuito generando Bits.
El empleo de transistores generadores de BITS, de los diodos y chips hicieron posible el desarrollo de las modernas computadoras parte fundamental de los equipos de radiología digital, mamografía digital, Tomografía Computarizada, Resonancia Magnética, equipos de SPECT y PET CT.
DIAGNÓSTICO RADIO ISOTOPICO
Es el uso de radioisótopos para generar imágenes para el diagnóstico médico.
Los isótopos son elementos químicos que tienen el mismo número atómico pero diferente peso atómico que los elementos que constan en la tabla de Mendeleyef, se llaman isótopos porque ocuparían el mismo puesto en la tabla, que está organizada según el número atómico. Los isótopos se clasifican en estables e inestables. Los estables no se modifican, no emiten radiaciones, los inestables cambian a otro elemento produciendo radiaciones alfa, beta o gama, por lo que se llaman Radio Isótopos, son trazadores, ya que al emitir radiaciones pueden ser localizados en el interior del cuerpo por medio de detectores en una gamma cámara. Los Radioisótopos pueden ser empleados solos , directamente, por la afinidad que algunos de ellos tienen por determinado tejido, por ejemplo el yodo 131 por el tiroides, Tecnesio 99 por la cubierta de los glóbulos rojos. En la Mayoría de los casos el Radioisótopo o trazador tiene que ir unido a un fármaco que lo va a llevar a su lugar de destino. Ejemplo: el Trazador Tecnesio 99 tiene que unirse al fármaco Octótride para que se vaya a localizar en los tumores Neuroendocrinos, constituyendo un radiofármaco, El trazador Tc99 se une al Fármaco Sulfuro Coloidal para formar un Radio-fármaco que se depositará en las células de Kuffer del hígado y del bazo.
Una vez administrado el Radiofármaco tenemos que ubicarle y, a veces cuantificarle, lo que se puede hacer en una Gamma cámara o en un equipo moderno, hibrido que es el SPECT CT.
La gamma cámara consta de un cabezal en donde están localizados los detectores de radiación y los foto-multiplicadores, este cabezal recorre el cuerpo, capta las señales de radiación y les transforma en imágenes bidimensionales.
SPEC CT es un equipo híbrido que consta de dos tomógrafos, el Tomógrafo de Fotón Único, que ubica la zona de captación del radiofármaco en el espacio, y el Tomógrafo Radiológico que produce la imagen anatómica, La imagen de fusión de estos dos tomógrafos nos demuestra el sitio anatómico donde se ubica la lesión que capta el radiofármaco.
De los radioisótopos usados en diagnóstico: el Yodo123, se produce en un ciclotrón por bombardeo del Telurio, el yodo 131 es un producto de fisión del Uranio 235 en un reactor nuclear, el Tecnesio 99 se produce por el bombardeo con neutrones del Molibdeno 98.
El SPECT CT se lo usa en oncología, cardiología, neurología, etc.
DIAGNÓSTICO POR TOMOGRAFÍA COMPUTADA
La Tomografía Axial Computada creada y desarrollada por Godfrey Hounsfield en 1972. El Tomógrafo computado, es un equipo radiológico que crea imágenes de cortes anatómicos, se compone básicamente de un tubo de Rayo X que emite un haz de radiación colimado de un grosor determinado, este tubo está instalado en un anillo, en el lado opuesto del anillo se encuentra un paquete de detectores de radiación, colocados uno junto al otro orientado paralelamente al haz de rayos X, este anillo gira alrededor del paciente mientras emite radiación, los rayos que atravesaron al paciente llegan a los detectores que transforman la radiación recibida en impulsos eléctricos que mediante algoritmos crean píxeles que forman la imagen anatómica de un corte.
Los tomógrafos de la primera generación solamente tenían una fila de detectores, por lo cual producían un corte por cada rotación del tubo, luego de cada rotación el tablero de la mesa se desplazaba la distancia del grosor del corte, y rotaba nuevamente para generar otro corte.
En 1989 se genera la Tomografía Computada Helicoidal, la cual consiste en la rotación continua del tubo y sensores, mientras gira el tubo con los sensores, el tablero de la mesa se desplaza al final de cada vuelta.
En el año 1998 se produce la Tomografía Computada Multicorte, la cual consiste en la colocación de varias filas de detectores: 4, 8, 12, 16, 32, actualmente hay tomógrafos de 160 filas de detectores. Estos tomógrafos producen 4, 8, 16, 32, 64 o164 cortes en cada vuelta del anillo tubo-detectores, lo que acorta enormemente el tiempo del procedimiento, y facilita el estudio de los órganos en movimiento.
Boxel Isométrico, la imagen digital que produce la Tomografía Computada está constituida por Pixeles, que son la mínima expresión de la imagen bidimensional. El haz de Rayos X es colimado a un grosor determinado, que producirá el grosor del Pixel, de esta forma el pixel adquiere una tercera dimensión y se denomina Boxel. Los tomógrafos modernos producen Boxels Isométricos o sea que tiene la misma dimensión en todos sus lados. Gracias a los Boxeles Isométricos los cortes axiales pueden producir reconstrucciones coronales, sagitales y oblicuas, lo mismo que reconstrucciones volumétricas de calidad.
Los Tomógrafos modernos tienen programas de reducción de dosis, por colimación automática, modulación de dosis.
La Tomografía Computada se la usa en el diagnóstico en Neurología, Neumología, Cardiología, Cirugía, Oncología, en fin en casi todas las especialidades médicas.
IMÁGENES POR RESONANCIA MAGNÉTICA
La Resonancia Magnética es una manera de crear imágenes diagnósticas de la anatomía humana, mediante un campo magnético y ondas de Radio Frecuencia.
En 1971 en la Revista Science, Raymond Damadian, un médico de origen armenio, de la Universidad de New York, informó que los tumores y los tejidos normales, se podían graficar en vivo por la técnica de Resonancia Magnética.
Damadian creo la primera máquina de Imágenes por Resonancia Magnética y presentó la primera patente.
El equipo de Resonancia Magnética está estructurado fundamentalmente por un potente imán, un generador de Radio Frecuencia, y un sistema de bobinas que sirven como antenas., todo esto dentro de una jaula de Faraday, aislante para la Radio Frecuencia. Los primeros Resonadores usaron imanes permanente de 0.02 Teslas de potencia, luego aparecieron electroimanes con bobinas refrigeradas, y finalmente electroimanes con bobinas superconductivas utilizando temperaturas bajas como -273 grados del helio líquido, logrando electro imanes de 1.5 T, de 3 y 7 T.
FÍSICA DE LA RESONANCIA MAGNÉTICA
Los átomos más abundantes en el cuerpo humano son los de hidrógeno del agua, el átomo de hidrógeno está constituido por un protón y un electrón, poseen un excedente de carga positiva en el núcleo, por lo que los protones se encuentran girando sobre su eje como trompos, este movimiento se denomina spin o momento magnético, convirtiendo a cada protón en un pequeño imán. Cuando se introduce un cuerpo en un campo magnético, este se magnetiza temporalmente, que quiere decir con esto, primero que los núcleos de los átomos van a girar a una velocidad llamada frecuencia de precesión, dependiente del tejido y de la potencia del magneto, segundo que los momentos magnéticos de cada uno de los núcleos de hidrógeno se alinean con el campo magnético, creando el llamado “vector de magnetización neta, dicho vector es la suma de los vectores de cada uno de los átomos”. Esto se llama Magnetización Longitudinal. Cuando a los tejidos que están en Magnetización longitudinal se aplica un pulso de Radio Frecuencia, que sea igual a la frecuencia de precesión de los spines, se produce una inclinación, y la Magnetización Longitudinal se torna Magnetización Transversal, según el tiempo que dure el estímulo con la onda de R.F la magnetización transversal será de 90° o 180 °.
Cuando se suspende el pulso de radio frecuencia los protones vuelven a su menor nivel de energía, y liberan la energía tomada de la radio frecuencia como una corriente eléctrica L, llamada señal de resonancia magnética o eco que es captada por una antena para cuantificar el tiempo que la magnetización transversal desaparece (Tiempo de Relajación transversal o T2) y el (Tiempo de Relajación Longitudinal T1.
Al tiempo trascurrido entre la emisión de la señal de Radio Frecuencia y la captación de la señal de resonancia magnética se lo conoce como Tiempo de Eco (TE) que es uno de los factores importante en las diferentes secuencias.
Al tiempo de relajación longitudinal se lo llama T1 y al tiempo de relajación trasversal T2. Los tiempos de relajación son propios de los tejidos y nos van a dar información de la composición de los tejidos examinados.
Un solo pulso de Radio Frecuencia va a producir una señal de respuesta muy leve, por lo que es necesario usar más de un pulso esto se denomina una (Secuencia de Pulsos), un factor que se puede modificar es el tiempo entre pulsos sucesivos, lo que se denomina Tiempo de Repetición (TR).
SECUENCIAS BÁSICA USADAS EN RESONANCIA MAGNÉTICA
Spin echo potenciada en T1, usando un TR y un TE cortos, en esta secuencia se producen imágenes de excelente detalle anatómico, el agua produce una señal de baja intensidad y la grasa una señal de alta intensidad.
Spin echo potenciada en T2 se logra con TR y TE largos, en esta secuencia el agua tiene una señal de alta intensidad, es útil en la identificación de lesiones patológicas que se caracterizan por un aumento en el contenido de agua.
Las Secuencias de Inversión Recuperación son un una variante de las secuencias spin echo, se usa un pulso de 180° antes de la secuencia spin echo, se lo llama pulso de inversión o Tiempo de Inversión TI que se lo usa para invertir o anular selectivamente la señal de un tejido. Si se usa un TI corto, se anula la señal de la grasa, a esta secuencia se lo llama STIR (Short TI Inversion Recovery). Si se usa un TI largo se elimina la señal del agua se lo conoce como FLAIR (Fluid Attenuated Inversion Recovery).
Las Secuencias Funcionales en Resonancia Magnética son:
- Imágenes de Difusión DIW
- Tensor de Difusión DTI
- Espectroscopia SRM
- Perfusión PRM
Las Secuencias Funcionales se suman a las secuencias convencionales dando a la Resonancia una mejor capacidad diagnóstica elevando la sensibilidad y la especificidad.
MATERIAL DE CONTRASTE USADO EN RESONANCIA MAGNÉTICA
El material de contraste que se usa en Resonancia Magnética es el Gadolinio que es un material paramagnético que acorta el TR en T1 , por lo que produce señales hiper intensas en los tejidos vascularizados, mejorando la capacidad diagnóstica.
La Resonancia Magnética fue usada en un comenzó para el diagnóstico de patología intracraneal, pero en la actualidad se lo usa en patología osteoarticular, en patología cardíaca en patología abdómino pélvica, tiene múltiples aplicaciones en Oncología.
DIAGNOSTICO POR TOMOGRAFIA DE EMISION DE POSITRONES PET CT
Se trata de una técnica híbrida en la cual un tomógrafo gammagráfico se acopla a un tomógrafo de Rayos X. El primero produce la imagen metabólica, de los sitios donde se captó el radiofármaco y el segundo la imagen anatómica total del cuerpo. Cuando unimos las dos imágenes (Imagen de Síntesis) podemos apreciar toda la anatomía del cuerpo, y en color los órganos o tejidos donde fue captado el radiofármaco.
Cuando usamos como radiofármaco el 18 FDG (18 Fluor-2-deoxi-glucosa) estamos valorando los sitios en donde está incrementado el metabolismo de la glucosa.
En el radiofármaco 18FDG el radionúclido es la 18F, un isótopo inestable del flúor, producido en un ciclotrón por bombardeo del oxígeno, este isótopo radioactivo al decaer produce positrones, y como todos los radioisótopos productores de positrones tiene un tiempo de semi-desintegración muy corta: 110 minutos, por lo cual el sitio de producción: ciclotrón, debe estar muy cerca del sitio de utilización: el PET.
COMO SE PRODUCE LA IMAGEN EN EL PET
El 18F al decaer produce neutrinos y positrones, los positrones chocan con los electrones dando lugar a la formación de dos fotones gamma de alta energía: 511 kev, que se disparan en direcciones opuestas en un ángulo de 180 grados. Estos dos fotones gamma son utilizados por el tomógrafo de positrones para producir la imagen.
El tomógrafo de emisión de positrones tiene un anillo que rota alrededor del cuerpo mientras este se desplaza en su interior, en toda la superficie interna de este anillo se encuentran decenas de detectores, compuestos por un cristal de fotoluminiscencia y un foto multiplicador, los detectores son estimulados por los fotones disparados en direcciones opuestas, y transforman la señal gamma en señal eléctrica que es enviada a un sistema de computación que lo transforma en imagen y lo sitúa en el espacio .
IMAGEN DEL PET CT
La imagen de síntesis es la suma de la imagen metabólica producida por el PET y la imagen anatómica, producida por el Tomógrafo Computado situado hacia cefálico del PET.
En las imágenes metabólicas se observa órganos y tejidos que normalmente captan el radiofármaco como el cerebro, el corazón, los riñones uréteres y vejiga, los intestinos, y los tejidos en los que patológicamente se encuentra aumentado el consumo de glucosa como los tumores primarios, sus metástasis a distancia y las adenopatías tumorales.
La cantidad del radiofármaco captada por una lesión puede ser medida y se expresa como SUV (Stándar Uptake Value).
¿Qué utilidad tiene el FDG PET en Oncología? Depende el tipo de tumor, en algunos tumores será de utilidad en el diagnóstico en otros en el estadiaje y detección de metástasis a distancia. Existe ya un acuerdo de la utilidad de FDG PET en los diferentes tipos tumorales.
Está probada la utilidad del FDG PET en diagnóstico en las siguientes circunstancias:
- Cuando las características de la lesión no son definitivas de benignidad ni malignidad-
- Detección del primario en paciente que se manifiesta por metástasis.
- Para identificar el tejido representativo en la toma de biopsias.
- Detección del tumor frente a marcadores tumorales anormales.
- Estadiaje del tumor luego del diagnóstico histopatológico.
- Respuesta terapéutica, durante el tratamiento o al finalizarlo.
- Reestadiaje.
- Sospecha de recurrencia.
UTILIDAD DE FDG PET EN VARIOS TIPOS DE NEOPLACIAS
EN LINFOMA
Existe mucha evidencia de la utilidad del FDG PET en el estadiaje, reestadiaje y evaluación pos tratamiento del linfoma de Hodgkin y en el linfoma no Hodgkin. No es de utilidad en: linfomas de bajo grado, leucemia linfocítica crónica, linfoma de zona marginal, tejido linfoideo asociado a la mucosa bucal (MALT).
EN TUMORES OSEOS Y DE TEJIDOS BLANDOS
Está demostrado el valor del FDG PET en el diagnóstico, estadiaje, y encuentro de recurencias en el Sarcoma de Ewing, es superior a otros métodos diagnósticos en la detección de metástasis medulares. La detección de metástasis pulmonares se lo hace en las imágenes de Tomografía Radiológica de PET.
EN CANCER DE SENO
El uso del FDG PET se halla limitado en el diagnóstico del cáncer inicial y en nódulos axilares, es muy útil en el hallazgo de metástasis en el cáncer local avanzado y, en el cáncer inflamatorio.
EN CARCINOMA HEPATO CELULAR
El estudio indicado en el diagnóstico y seguimiento de los Hépato Carcinomas es la TC Multicorte contrastada trifásica, no hay lugar para el FDG PET.
EN CARCINOMA DE VESICULA BILIAR
El Carcinoma de vesícula biliar es un tumor ávido por la glucosa. El estudio de FDG PET tiene una sensibilidad diagnóstica del 95% para el tumor y un 85% para de detección de metástasis ganglionares.
EN CARCINOMA DE PANCREAS
En el diagnóstico y estadiaje del cáncer de páncreas tiene utilidad la TCM (Tomografía Computada Multicorte) y la Resonancia Magnética, el FDG PET no tiene ningún papel.
EN CÁNCER GASTRICO
El estudio de FDG PET no se lo emplea en el diagnóstico de cáncer gástrico, debido a que las células normales del estómago captan y eliminan el FDG, quizás tenga utilidad en el diagnóstico de metástasis peritoneales.
EN CÁNCER COLO RECTAL
El diagnóstico y estadificación del cáncer colónico se lo hace con TCM (Tomografía Computada Multicorte) y con Resonancia Magnética en el cáncer rectal. El FDG PET es de utilidad en el diagnóstico de las metástasis extra hepáticas.
Es de mucha importancia en la valoración temprana del tratamiento de Neo adyuvancia, y en el diagnóstico de las recurrencias del carcinoma colo-rectal.
EN CÁNCER DE TIROIDES
El cáncer de tiroides moderadamente diferenciado y el no diferenciado, es ávido por FDG y no por el yodo de la gammagrafía. Lo contrario sucede con el cáncer tiroideo bien diferenciado, es ávido por el yodo y no ávido por el FDG, este fenómeno se lo conoce como flip-flop y debe ser considerado para el estudio con FDG PET del cáncer de tiroides.
El FDG PET, identifica las metástasis que no identificó la gammagrafía con yodo. Para el cáncer de tiroides no diferenciado y anaplásico, el FDG PET es el estudio indicado.
EN LINFOMA DEL SISTEMA NERVIOSO CENTRAL
El tejido linfomatoso en el sistema nervioso central capta FDG de 2 a 3 veces más que el tejido cerebral normal, por lo que se puede hacer diagnóstico diferencial entre linfoma y glioblastoma o enfermedad metastásica.
EN CÁNCER DE PULMÓN
El FDG PET combinado con el TCMD es la modalidad más eficiente para el estudio del Cáncer pulmonar. El PET tiene capacidad para diferenciar el tumor del tejido pulmonar atelectasiado, de identificar invasión a las paredes torácicas y en la identificación de metástasis pleurales. Tiene un valor predictivo positivo del 65% en el diagnóstico de ganglios tumorales en mediastino, pero con un valor predictivo negativo del 95 %.
El FDG PET es la mejor modalidad de imagen en la detección de metástasis óseas, es el mejor predictor de respuesta al tratamiento y es el mejor detector de recurrencias.
EN CÁNCER PULMONAR DE CÉLULAS PEQUEÑAS
Tiene una alta sensibilidad y especificidad en la detección de metástasis a distancia, excepto para las metástasis al cerebro, en las que la indicación es la Resonancia Magnética.
EN MESOTELIOMA PLEURAL MALIGNO
Se recomienda el FDG PET para el estadiaje y reestadiaje del mesotelioma pleural maligno. El FDG PET puede diferenciar lesiones pleurales maligna de las benignas, lesiones con un SUV de más de 2.2 se las considera malignas.
EN TUMORES DEL TIMO
El FDG PET está recomendado para el diagnóstico, y estadificación de los tumores del timo, puede diferenciar los timomas de bajo riesgo (del tipo histológico A, AB, B1) de los timomas de alto riesgo (del tipo histológico B2, B3, y Carcinoma del timo), de acuerdo con los valores del SUV.
EN CÁNCER DE ESOFAGO
Para el estadiaje del cáncer inicial del esófago, el examen ideal es la ecografía trans endoscópica que puede valorar la penetración del tumor en las paredes esofágicas, el FDG PET no tiene la resolución espacial para diagnosticar la profundidad de la invasión tumoral.
El FDG PET es la mejor modalidad para la detección de metástasis ganglionares y para detectar metástasis a distancia.
EN CÁNCER PROSTATICO
El FDG PET es útil para la detección de metástasis, especialmente óseas.
El cáncer de próstata se lo estudia con RM.
EN CÁNCER RENAL
El FDG PET es útil para el reestadiaje y para el diagnóstico de las metástasis.
EN CÁNCER TESTICULAR
El FDG PET tiene valor en el estudio del seminoma, no así en caso del Tumor de Células Germinales, en el cual el valor predictivo negativo es muy bajo.
EN MELANOMA
El FDG PET es el método ideal para el estudio de ganglios y metástasis, así como para la detección de metástasis de localización de mucosas de cuello, cabeza, y ano-rectales.
DIAGNÓSTICO ECOGRAFICO O ULTRASONOGRAFICO
Es el procedimiento de diagnóstico médico en el cual usamos las ondas sonoras ultrasónicas, no audibles para el oído humano, para producir imágenes de los tejidos y órganos del cuerpo.
Todo comienza en 1881 con el descubrimiento por los esposos Curie del efecto piezoeléctrico de los cristales de cuarzo y algunas cerámicas, efecto piezoeléctrico es la propiedad de emitir ondas de ultrasonidos cuando reciben un estímulo eléctrico y a la inversa producir una señal eléctrica cuando en su superficie reciben ondas sónicas.
La frecuencia del sonido se mide en ciclos por unidad de tiempo: ciclos por segundo, se denomina Hertzio a un ciclo en un segundo, kilo Hertzio 1000 ciclos por segundo, y Mega Hertzio a 1.000.000 ciclos por segundo La frecuencia del sonido que detecta el oído humano se sitúa entre 15 y 20.00 Hz, los equipos de ecografía utilizan frecuencias sobre los 20.000Hz, son ultrasonidos, no detectables por el oído humano.
El primer ecógrafo de uso médico en 1949 era muy simple, tenía un transductor de un solo cristal piezoeléctrico, se lo utilizó para medir el desplazamiento de las estructuras de la línea media en las hemorragias intracraneales.
Los tejidos del cuerpo humano oponen resistencia a ser atravesados por las ondas sónicas, esto se denomina impedancia del tejido, las ondas sónicas son atenuadas por pérdida de energía cuando atraviesan los tejidos. Se llama interfaces los límites entre tejidos que tienen diferentes impedancias.
Un porcentaje de Ultrasonidos no atraviesa los tejidos, sino que rebota hacia el transductor, los Ultrasonidos que rebotan se denominan ecos. La producción de ecos en los tejidos depende de la cantidad de interfaces que tenga el tejido o el órgano, la vesícula biliar, por ejemplo, está llena de un líquido homogéneo , que no tiene interfaces y no produce ecos, es anecoica, no sucede lo mismo con el tejido hepático esteatósico, que tiene muchas interfaces en las cuales rebotan los sonidos, es un tejido muy ecogénico. Los ecos que llegan al cristal del transductor tiene su intensidad , y un tiempo de llegada, la velosidad media con que los ultrasonidos viajan en el tejido de nuestro cuerpo es de 1540 m/s , conociendo el tiempo que el eco demoró en llegar al trasductor , se conoce a la profundidad que se encuentra el tejido ecogénico.
A los cristales del transductor le llegan una cadena de ecos de diferentes intensidades, y a diferentes tiempos, y el cristal los transforma en señales eléctricas que se envían a un digitalizador que lo convierte en información binaria que lo procesa un ordenador.
Un equipo de ecografía está constituido por un cuerpo o base en el que se encuentra toda la electrónica: el generador de los pulsos eléctricos, el digitalizador, el ordenador, los mandos y botonería. Las pantallas o monitores, en las que se analiza las imágenes que produce el equipo: bi o tridimensionales, imágenes biplanares en escala de grises, imágenes dinámicas, imágenes a color como son las de el Doppler.
Sistemas de impresión, lo más frecuente en la actualidad es que las imágenes se envíen a un archivo digital y de allí a ser impresas en películas, papel, o a ser editadas en discos en sistema DICON.
TRANSDUCTORES En la actualidad casi todos son electrónicos, se los fabrican de diferentes formas: sectoriales, lineales, intracavitarios, de acuerdo al tipo de examen
al que se los va a dedicar, con diferentes tipos de frecuencia, desde 3.5, 5, 7, 13 y hasta 20 MH. Los de más baja frecuencia tienen mayor penetración pero menor definición, los de más alta frecuencia tiene menor penetración pero mejor definición.
VENTAJAS DEL DIAGNÓSTICO POR ULTRASONIDOS
La principal ventaja del diagnóstico por ultrasonidos es que no usa radiaciones ionizantes, nada de rayos X , nada de radiaciones gama, solo ondas sónicas , inocuas, motivo por el que podemos emplearlo en nicho pequeños , inclusive en embriones y fetos, los equipos ecográficos son baratos en comparación con los otro métodos diagnósticos, son más transportables permitiendo el examen en el cuarto del paciente, es una técnica muy versátil, permite ver desde una astilla en el pulpejo de los dedos, hasta los ventrículos del cerebro de un niño y las válvulas cardíacas.
Cada día se reconoce más campos de aplicación del diagnóstico por ultrasonidos: estudio del bienestar fetal, valoración del cerebro del recién nacido, diagnóstico ecocardiográfico de las cardiopatías en el feto, ecografía de hígado, vías biliares y páncreas, ecografía de la impotencia, estudio ecográfico de las enfermedades reumáticas, ecografía del sistema vascular, ecografía de los tegumentos, etc. Etc.
DESVENTAJAS DEL DIAGNOSTICO POR ULTRASONIDOS
La mayor desventaja es que puede ser usado por personas no preparadas, inclusive no médicos, que creen que la especialidad de ecografista es comprar un equipo de ecografía, cualesquiera, hacer un curso de ocho días dictado por un inescropuloso, y poner un gran rótulo “Ecografía 4D a color” si es en un centro comercial mejor.
El diagnóstico por ultrasonidos es parte de una especialidad médica, que debe ser tratado con responsabilidad. Me molesta cuando escucho “el eco es operador dependiente”. Todo en medicina depende de la preparación de quien lo ejecuta, la cirugía no puede ser más dependiente de la preparación del operador. La ecografía es una rama del Diagnóstico por Imágenes que debe ser hecho por un especialista bien preparado.
Figura 1

A. Wilhein Conrad Röntgen descubridor de los Rayos X,
B. Radiografía de la mano de la esposa de Röntgen.
C Radiografia de una mano con técnica actual.
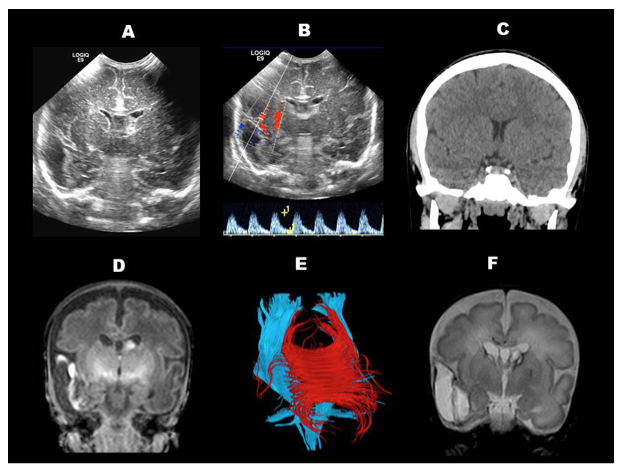
Figura 2

A Eco transfontanelar del cerebro.
B Eco trasfontanelar con registro Doppler de la arteria cerebral media.
C corte coronal del cerebro con Tomografía Computada.
D y F Corte coronal del cerebro con Resonancia Magnética. E Imágenes de Resonancia Magnética de los tractos nerviosos, con tensores de difusión.
Figura 3 Arteria Subclavia Derecha Aberrante

A Dibujo de la arteria subclavia aberrante hecho por Kumerel en 1936.
B Reconstrucción volumétrica de la Angiotomografia
C Reconstrución volumétrica de la Angio Resonancia
Figura 4 Arco aórtico derecho circunflejo

A dibujo esquemático.
B Reconstruccón volumétrica de la angio tomografía.
C Esofagograma compresión por el anillo vascular.
Figura 5 Carcinoma Papilar de Tiroides

A Imagen de Síntesis del FDG PET + CT
B Imagen del FDG PET
[/vc_column_text][/vc_column][/vc_row]

Deja una respuesta
Lo siento, debes estar conectado para publicar un comentario.